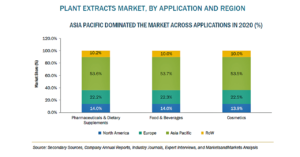
生物製剤の安全性試験の市場規模、2026年に62億米ドル到達予測
生物製剤の安全性試験の市場規模は、2021年の34億米ドルからCAGR12.4%で成長し、2026年には62億米ドルに達すると予測されています。生物製剤の安全性試験市場の成長は、生物製剤およびバイオシミラー市場の成長、細胞培養の汚染に対する懸念の高まり、バイオ医薬品の研究開発活動および投資の増加などの要因によってもたらされています。また、新興市場やバイオ医薬品のアウトソーシングの増加は、市場のプレーヤーに大きな成長機会を提供すると予想されます。
COVID-19の生物製剤の安全性試験市場における影響
既存の製薬会社やバイオ医薬品会社の組み合わせが、生物製剤の安全性試験市場のプレーヤーとともに、COVID-19を標的とした治療法やワクチン製造のための安全性試験キットや生物製剤安全性試験を提供しています。
COVID-19感染者の増加に伴い、ワクチン製造が増加することが予想されるため、生物製剤の安全性試験は、患者の安全を確保するための重要な品質保証手段となります。また、COVID-19治療薬として、米国食品医薬品局(FDA)から、2つの抗SARS-CoV抗体製品である、BamlanivimabとCasirivimab および Imdevimab カクテルが使用を緊急に認可されました。さらに、COVID-19の研究や医薬品開発にエンドトキシン検査を導入する動きが活発化しており、市場の成長を後押ししています。COVID-19パンデミックの経済的・社会的負担を受けて、各国政府はワクチン開発への支援を強化しており、それに伴いCOVID-19研究用のエンドトキシン検査製品の採用が増加しています。
牽引要因:バイオシミラーおよび生物製剤市場の成長
多くの企業が生物製剤やバイオシミラーの開発に多額の投資を行っています。現在、発見段階にある医薬品候補の半数以上が、タンパク質、ペプチド、モノクローナル抗体などの生物製剤です。生物製剤は、今後数年間で、上位100品目の医薬品が生み出す収益の約半分を占めると予想されています。
FDAによると、米国で新たに承認された生物製剤の数は、2016年の22種類から2019年には48種類に増加しています。生物製剤やバイオシミラーの開発を目的としたバイオ医薬品企業の投資が拡大していることから、世界的に承認される製品の数がさらに増加することが予想されます。